Hoe mini-tumoren uit de 3D-printer bijdragen aan betere immunotherapie.

Liao et al. (2024)
Leidse onderzoekers hebben een nieuw model ontwikkeld om immunotherapie tegen kanker te verbeteren. Met een 3D-printer creëren ze mini-tumoren in een omgeving die lijkt op menselijk weefsel. Ook ontwikkelden ze een manier om in real-time te volgen wat er tijdens tests in deze mini-tumoren gebeurt.
Hoe goed werkt nieuwe immunotherapie tegen kanker? Onderzoekers van het Leiden Academic Centre of Drugs Research (LACDR) hebben een methode ontwikkeld om dit beter te testen. ‘Hiermee testen we verbeterde T-cellen en bispecifieke antilichamen op effectiviteit,’ vertelt promovendus Anita Liao, ‘zodat alleen de meest veelbelovende kandidaten doorgaan voor verder onderzoek en ontwikkeling richting de kliniek.’
Immunologie: immuuncellen helpen met aanvallen:
Kankercellen zijn goed in verstoppertje spelen. Op allerlei manieren verbergen ze zichzelf voor het immuunsysteem, en slaan zelfs aanvallen af. Immunotherapie helpt het immuunsysteem om kankercellen beter te herkennen, aan te vallen, en uiteindelijk te vernietigen. Dit kan bijvoorbeeld door met medicijnen het immuunsysteem te versterken, door de kankercellen beter vindbaar te maken of door T-cellen kunstmatig te verbeteren. Het Leidse onderzoek richt zich op nieuwe testmethodes voor de laatste twee aanpakken.
Adoptieve T-celtherapie: T-cellen zijn een speciaal type immuuncel die kankercellen kunnen aanvallen. Op deze cellen zitten receptoren: een soort voelsprieten die kankercellen kunnen herkennen. Door T-cellen van een patiënt te isoleren, en deze te bewapenen met betere receptoren en vervolgens aan de patiënt terug te geven, krijg je T-cellen die de kankercellen beter kunnen herkennen en aanvallen.
Bispecifieke antilichamen: Deze antilichamen grijpen met één armpje de T-cel vast en met de andere arm de kankercel. Zo helpen ze T-cellen om de kankercellen sneller op te sporen en te vernietigen.
Een kweekschaaltje lijkt niet op het menselijk lichaam:
Het testen van nieuwe immunotherapie gebeurde tot nu toe door tumorcellen, T-cellen en soms antilichamen bij elkaar in een kweekschaaltje te stoppen en gezamenlijk op te kweken. Onderzoekers observeren dan hoe de cellen op elkaar reageren, en of de T-cellen in staat zijn om de tumorcellen te doden. ‘Helaas werkt dit in het menselijk lichaam net anders,’ legt hoogleraar Cancer Drug Target Discovery Erik Danen uit. ‘In het kweekschaaltje groeien de T-cellen tussen de tumorcellen en kunnen daardoor direct beginnen die te doden. In werkelijkheid is dat veel complexer; T-cellen moeten eerst hun weg vinden naar de tumor. Dat vormt een extra uitdaging.’
Mini-tumoren in 3D printen en real-time bekijken:
De onderzoekers ontworpen een realistischer model, met mini-tumoren in een gel van collageen. Liao: ‘Deze gel lijkt op weefsel in het menselijk lichaam. We gebruiken een 3D-bioprinter met een speciale naald waarin we de tumorcellen stoppen. Deze naald injecteert de tumorcellen vervolgens in de gel, en maakt zo kleine, driedimensionale tumoren. Deze groeien in de gel en lijken sterk op echte tumoren in het lichaam. Vervolgens voegen we T-cellen toe die hun weg naar de tumor moeten vinden. We kunnen er snel en op grote schaal T-cellen en antilichamen mee testen.’
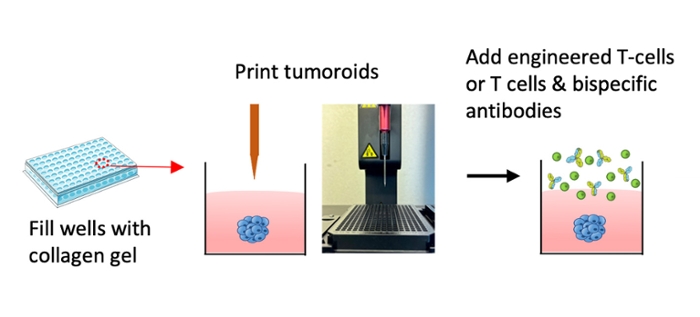
Een 3D-bioprinter creërt kleine, driedimensionale tumoren in collageengel die verder uitgroeien. Vervolgens voegen de onderzoekers T-cellen toe en kijken wat er gebeurt.
Beeld: Liao et al. (2024)
Daarnaast ontwikkelden de onderzoekers een systeem om deze mini-tumoren in real-time met geautomatiseerde microscopen te volgen en analyseren. Zo kunnen ze precies zien wat er in en rondom de tumor en immuuncellen gebeurt. Danen: ‘We zien niet alleen of en hoe de verbeterde T-cellen en antilichamen werken, maar leren ook welke verdedigingsstrategieën de tumorcellen inzetten.’
‘Zo kunnen we de meest effectieve anitlichamen selecteren voor verdere ontwikkeling richting een echte behandeling.’
Inzicht in effectiviteit: nieuwe testmethode maakt het verschil:
De nieuwe methode wierp direct zijn vruchten af bij het testen van verschillende bispecifieke antilichamen. De onderzoekers ontdekten dat niet alle antilichamen effectief waren, terwijl dit in de oude testmodellen wel het geval leek. Danen legt uit hoe dit kan. ‘In het nieuwe, complexere model zagen we dat de meest effectieve antilichamen niet alleen de T-cellen activeren, maar ook de productie van signaalstoffen stimuleren die weer andere T-cellen aantrekken. Bij de oude testmethode kregen de antilichamen daar de kans niet voor, omdat de T-cellen daar direct begonnen met het doden van de tumorcellen. Deze belangrijke dynamiek werd dus niet zichtbaar en we zagen geen verschil tussen goed- en slechtwerkende antilichamen. Onze nieuwe methode zal helpen de meest effectieve antilichamen te selecteren voor verdere ontwikkeling richting een echte behandeling.’

Een tumor waaraan respectievelijk inactieve en effectieve antilichamen aan zijn toegevoegd. In groen de mobilisering van T-cellen, in het rood het doden van de tumor.
Op weg naar nieuwe behandelingen tegen borst- en oogkanker:
Danen en zijn team testen met het model ook al verbeterde T-celreceptoren. Een voorbeeld hiervan zijn de receptoren uit het lab van immunoloog Mirjam Heemskerk van het Leids Universitair Medisch Centrum, die T-cel-receptoren maakte om oogkanker te behandelen. Ook werkten ze samen met het immunologielab van Reno Debets van het Erasmus Medisch Centrum in Rotterdam. ‘Hier testten we nieuwe receptoren voor borstkankertherapie’, aldus Danen. ‘Ons model heeft bewezen goed te kunnen voorspellen welke receptoren succesvol zullen zijn in muismodellen. Deze verbeterde receptoren zijn nu klaar voor klinische tests in echte patiënten. We hopen dat ons onderzoek een goede stap vooruit is in de selectie van optimale behandelingen voor kankerpatiënten.’
